国内凝血分析流水线产品盘点(沃芬/希森美康/思塔高和艾科达)
随着国家医疗改革的不断深入,使得综合性大中型医疗机构的中心实验室对自动化系统有了新的要求,为了简化检测流程,提高检测效率,保证数据准确度等,中心实验室对集中化诊断
来源:医疗器械注册代办 发布日期:2022-07-06 阅读量:次
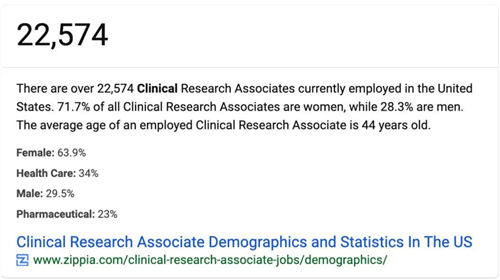
前段时间一个朋友发了一个截图给我,说他检索到美国有2万多名CRA,问我:“你们知道的数据比较多,国内目前到底有多少CRA啊?”
图:公开资料显示美国有22574名CRA,71.7%为女性,28.%为男性,平均年龄为44岁
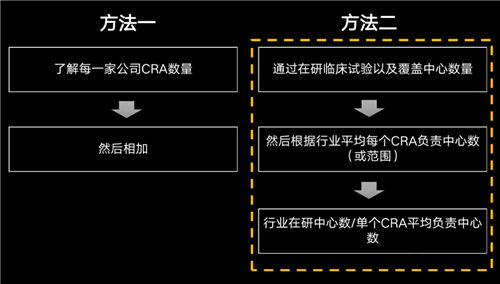
计算国内CRA数量的方法可能有很多种,如下两种个人觉得还是相对靠谱的:
方法一:统计行业内各家CRO、药企公司内CRA数量,相加即可。
方法二:通过分析在研临床试验以及覆盖的中心数量,然后根据行业平均每个CRA负责中心数,最后利用行业在研中心数除以单个CRA平均负责中心数,即可得到CRA数量。
当然方法一肯定更加精准,但执行起来难度比较大,基于数据优势,今天用方法二给大家大致推算国内到底有多少CRA!
利用使用方法二计算国内CRA数量,首先要了解国内在研的临床研究及覆盖中心情况!
我们对CDE药物临床试验信息登记与公示平台的试验做了分析,截至2022年5月28日,在CDE登记公示平台上标识为“进行中”的项目有7713个,当然“进行中”也包含3种状态,分别是“尚未招募”、“招募中”及“招募完成”。
如果已经在CDE平台登记且状态是“进行中-尚未招募”大概率项目还在SSU期间,这类项目有2625个;
“进行中-招募中”项目有3510个,这类项目大家可以当做是在入组期!
“进行中-招募完成”项目有1575个,这类项目应该在随访或关中心期!

7713个“在研”项目分布在1520家中心,1520是去重之后的结果,如果不去重,则有78020个Site频次有在研的项目在进行!
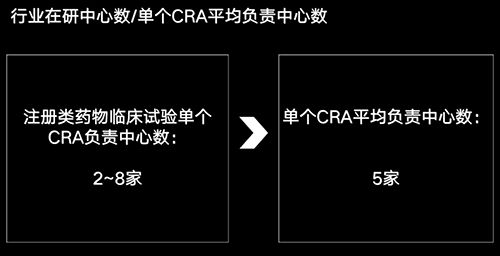
我们知道在CDE登记的都是注册类药物试验,针对注册类项目,有过CRA相关经验的都知道,每个CRA负责中心数一般在2~8家。
当然CRA负责的中心数量和CRA经验、企业性质(CRO or 药企)、项目类型、项目阶段、入组受试者数量等很多因素有关系。
今天我们用平均数5作为行业的“单个CRA平均负责中心数”。大家不用太较真这个数字是不是精准,因为今天只是介绍一种方法,得出一个相对靠谱的、可供大家参考的粗略数字。
这样国内CRA数量就呼之欲出了,78020 ➗ 5= 15604。当然这是基于CDE公示的临床试验数算出来的,而大家都知道,在CDE登记公示的临床试验都是注册类药物临床试验,所以可以得出这样的结论:国内从事注册类药物临床试验监查的CRA差不多有1.5万人!
除了注册类药物临床试验,我们知道还有大量的CRA在负责上市后的药物临床试验,另外也有不少器械类的CRA!

当然在“中国临床试验注册中心”上登记了很多非注册类药物及一些器械类试验,因为绝大部分都是IIT(研究者发起类)研究,这些项目很多不一定有监查,所以不太能作为参考数据!
不过个人经验,综合以上3个部分,国内CRA数量和美国应该差别不大,往多一点说应该在3万左右!
之前听行业内有人说5万、甚至10万的,肯定是达不到的!
注:有的朋友可能会提醒,在CDE登记公示的试验可能不够精准,确实有一些企业会晚一些更新自己的试验状态,有可能试验结束了显示的还是“进行中”,甚至新增或删除了一些中心也没有及时上去更新。这一点大家不用太担心,这几年随着CDE及药物临床试验机构对这块试验公开的信息重视,信息登记公示越来越精准,这个原因造成的误差没有这么大!

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

随着国家医疗改革的不断深入,使得综合性大中型医疗机构的中心实验室对自动化系统有了新的要求,为了简化检测流程,提高检测效率,保证数据准确度等,中心实验室对集中化诊断

近日美国食品药品监督管理局(FDA)更新了《医疗器械提交的反馈申请和会议申请:Q-Submission指导原则》。此文件是对2019版Q-sub指导原则的更新,更新的主要内容如下:1. 增加了STeP医疗

一个产品带有CE 标志(标记) 也就意味着其制造商宣告:该产品符合欧洲的健康、安全、与环境保护之相关法律中所规定 的基本要求。因而该产品是对:使用者(译者注:人)、宠物(
体外诊断(In Vitro Diagnosis,下称IVD),是在人体之外,通过对人体样本(血液、体液、组织等)进行检测而获取临床诊断信息,进而判断疾病或机体功能的产品和服务。IVD已经成为人类

药品/化妆品/医疗器械企业卖假货无证销售罚多少钱?近期福建省发布药品医疗器械化妆品卖假货无证销售典型案例,一起来看看惩罚力度和罚款额度。"
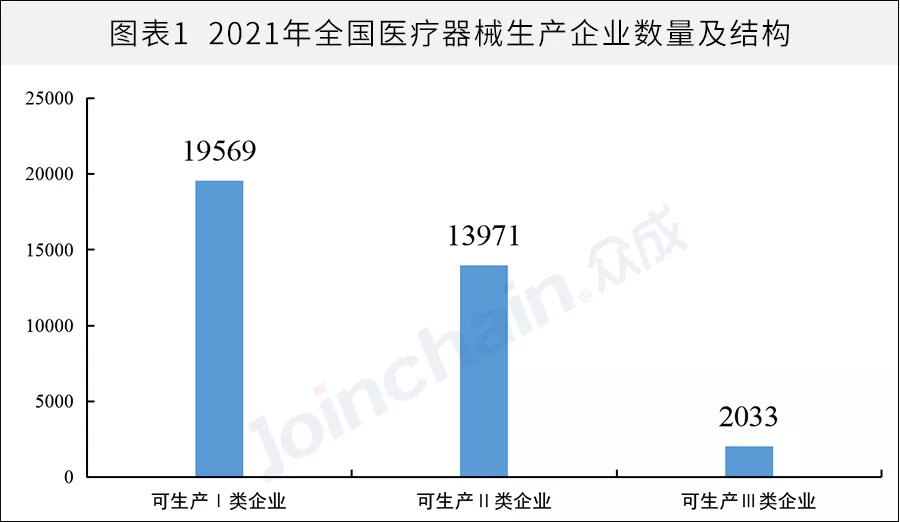
据众成数科统计,截至2021年12月31日,全国医疗器械生产企业数量达28954家,较2020年的25440家同比增长13.8%。其中,可生产Ⅰ类产品企业19569家,可生产Ⅱ类产品13971家,可生产Ⅲ类产品

在鹤壁办理一张医疗器械经营许可证要多少钱?只要有人员有场地满足办理的要求,就可以自行办理。自行办理是免费的哦!本文为大家科普一下找代办机构办理的情况下,鹤壁医疗器械经营许

美国食品药品监督管理局FDA宣布,其计划采用ISO13485标准作为其质量体系立法的基础。FDA如采用ISO13485标准替代其现有的质量体系法规,则代表该标准的认可度获得进一步的提高,已经成

随着医疗水平的不断提高,医疗器械已被广泛用于疾病诊断、预防、监护、治疗和康复等领域。任何已批准上市的医疗器械都不是绝对安全的,只有通过持续开展医疗器械不良事件监测
目前,使用经皮介入治疗房颤主要有三种手段,分别对应于三种不同类型的能量,脉冲电场消融(Pulsed ElectricField Ablation)、射频消融(R
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台