海南博鳌乐城国际医疗旅游先行区临床急需进口药品带离先行区使用管理暂行办法(琼药监综〔2020〕3号)
《海南博鳌乐城国际医疗旅游先行区临床急需进口药品带离先行区使用管理暂行办法》已经3月24日海南博鳌乐城国际医疗旅游先行区领导小组会议审议通过,现印发给你们,请遵照执行
来源:医疗器械注册代办 发布日期:2019-06-11 阅读量:次
附件:重组人凝血因子Ⅸ临床试验技术指导原则(2019年第31号).doc
血友病B是一种由凝血因子Ⅸ(Coagulation Factor Ⅸ, FⅨ)缺乏而导致的出血性疾病,是X染色体连锁的隐性遗传性疾病,主要由凝血因子Ⅸ基因突变引起。
血友病B的临床表现主要为关节、肌肉和深部组织出血,也可有胃肠道、泌尿道、中枢神经系统出血以及拔牙后出血不止等。若反复出血,不及时治疗可导致关节畸形和(或)假肿瘤形成,严重者可危及生命。根据患者FⅨ活性水平可将血友病分为轻型(FⅨ水平:5~40 %)、中间型(FⅨ水平:1~5 %)和重型(FⅨ水平:<1 %)。轻型患者一般很少出血,只有在损伤或手术后才发生;重型患者自幼可有自发性出血(可发生于身体的任何部位);中间型患者出血的严重程度介于轻型和重型之间。
FⅨ替代治疗是目前血友病B的主要治疗手段,一般首选基因重组FⅨ、病毒灭活的血源性FⅨ,在无法获得上述产品时可选用新鲜冰冻血浆等。FⅨ替代治疗可分为按需治疗和预防性治疗。
本指导原则旨在为重组人凝血因子Ⅸ(Recombinant Human Coagulation Factor Ⅸ, rhFⅨ)用于治疗和预防血友病B患者申请上市许可、或已上市产品发生重要生产工艺变更需开展临床试验时提供建议。
本指导原则可能无法涵盖临床试验的所有内容,对于实际应用中的特定产品和特定问题,应视具体情况具体研究决定。本指导原则亦将随科学技术发展和经验的积累而逐步完善。
本指导原则适用于治疗和预防血友病B患者出血症状的rhFⅨ制品上市前和上市后进行的临床试验;已获批产品发生重要生产工艺变更以致于可能影响产品的有效性和安全性,需要进行临床试验时,本指导原则同样适用。
临床研究应遵循《药品临床试验质量管理规范》(GCP)的要求。
由于血友病B发病率较低,上市前研究的数据可能不足以全面评估rhFⅨ制品的有效性和安全性(特别是免疫原性)。因此,为了更加全面的评估产品的有效性和安全性,并考察上市后常规用药与上市前临床试验结果的长期一致性,需对rhFⅨ制品开展上市后临床研究。
经治疗患者(Previous Treated Patients, PTPs):对于≥6岁患者,PTPs定义为曾接受FⅨ治疗且给药暴露日(Exposure Days, EDs)大于150EDs的患者;对于<6岁患者,PTPs定义为曾接受FⅨ治疗且给药暴露日大于50EDs的患者。
未经治疗患者(Previous Untreated Patients, PUPs):从未接受过FⅨ(新鲜冰冻血浆除外)治疗的患者。
抑制物:指FⅨ的中和抗体。
临床试验中纳入的血友病B患者应涵盖不同年龄段人群,包括成人和青少年(≥12岁)以及儿童(<12岁)。
鉴于经治疗患者(Previous Treated Patients, PTPs)人群中FⅨ的中和抗体(也称作抑制物)发生率较低,因此建议首先在PTPs中进行rhFⅨ制品的药代动力学、有效性和安全性研究,然后在未经治疗患者(Previous Untreated Patients, PUPs)中进行有效性和安全性的研究,特别是免疫原性的研究。所有rhFⅨ制品都须在PUPs人群中进行研究,上市前若未进行PUPs人群研究,说明书中不应涵盖此人群,且须在上市后补充PUPs人群中的研究。
建议首先在≥12岁PTPs受试者中获得单次给药的PK特征和初步安全性试验结果,以指导后续试验设计。
临床试验应从年龄≥12岁的PTPs受试者开始,在获得≥10名该受试者人群50EDs的试验结果后,再开始在<12岁受试者中的临床试验。在各年龄组中均应先进行药代动力学研究,了解药物代谢特征后,再进行有效性和安全性研究。
有效性和安全性研究的试验设计应包含按需治疗和预防性治疗。可根据受试药物的特征和试验目的设计合理的疗效评价和随访时间。一般情况下,按需治疗应完成≥6个月的疗效评价,预防性治疗应完成≥50EDs且≥6个月的疗效评价。
PUPs受试者的临床试验,需要在完成<12岁PTPs受试者的药代动力学研究,并且获得至少10名<12岁PTPs受试者≥50EDs的有效性及安全性数据后,才可以开展。PUPs的临床试验可在上市前或上市后开展。
建议在研究过程中,采用模型化和仿真的方法对成人和青少年组、儿童组数据进行综合分析,以充分挖掘已有数据,为后续试验设计提供参考。
为了评价输注rhFⅨ后血中凝血因子Ⅸ的恢复水平、止血或预防出血的疗效,并为安全性评估提供充分的信息,需要足够的受试者参加临床试验。
综合考虑受试药物有效性和安全性评价所需的临床数据与血友病B发病率,成人和青少年组(≥12岁)、儿童组(<12岁)的上市前临床试验的最低样本量均为20例,一般情况下,按需治疗和预防性治疗的评价均需达到上述样本量的要求,按需治疗与预防治疗可考虑采用序贯设计。
上市后应完成至少50名PTPs受试者的临床试验,并考虑年龄均衡。临床试验期间需要更多关注药物的安全性信息。通常情况下,参加上市前临床试验的受试者可以继续参加上市后研究。
PUPs人群研究需要在至少20名受试者中进行。
FⅨ效价测定受检测方法、试剂和参考/标准品的影响较大,测定方法造成的效价差异可能影响成品的效价标定和输注后的临床监测。当所用方法、试剂、参考/标准品发生变化时,建议考虑通过适宜的可比性研究评估其对效价测定的影响。
FⅨ效价和抑制物测定方法需按照相关指南进行充分的方法学验证,尤其是多中心临床试验中,建议由具有专业资质的中心实验室统一进行测定,若由各研究中心自行测定,则建议考虑各中心检测试剂、参考/标准品等的差异,并进行充分的方法学验证。
临床试验期间,建议对抑制物测定的时间点可以包括:第一次给药前、ED10-15、ED50-75、ED100,在FⅨ水平达到基线时采集样本进行抑制物测定。为监测抑制物,建议同时监测FⅨ活性回收率,测定的时间点可以包括:第一次给药(ED1)后、ED10-15、ED50-75、ED100。
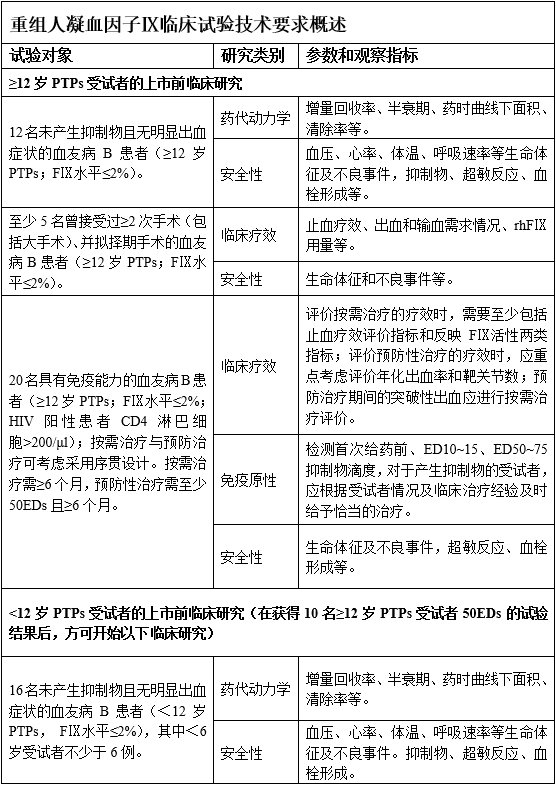
根据受试者人群的不同,rhFⅨ制品的上市前临床试验主要包括三部分:在≥12岁PTPs受试者中的研究、<12岁PTPs受试者中的研究以及PUPs受试者中的研究。
4.1.1 药代动力学研究
应在至少12名PTPs受试者中进行。受试者应为年龄≥12岁的中重型血友病B患者(FⅨ水平≤2%),具有免疫能力(HIV阳性患者的CD4 淋巴细胞>200/μl),受试者须为HIV阴性,或病毒载量<200粒/μl或<400000拷贝/ml的HIV阳性患者,且在试验前一定时期内没有输注过任何含FⅨ的产品,洗脱期具体时间根据试验前受试者所使用的FⅨ产品的半衰期制定,受试者入组时须无明显出血症状且无抑制物产生。
研究参数应包括增量回收率、体内消除半衰期、药时曲线下面积(AUC)和清除率等。
给药剂量可考虑选择50~75 IU/kg,应在输注前、输注结束后10—15分钟、30分钟、1小时采样,以获得增量回收率的结果。为使采样点包含活性-时间曲线的主要部分,后续采样点可根据rhFⅨ的类型和特点(如长效rhFⅨ制品)进行设计。临床试验过程中,应准确记录实际采样时间点。为保持一致性,建议在中心实验室进行药代动力学试验样本的检测。
参加药代动力学试验的受试者接受受试药物持续的预防性治疗3—6个月后,需重新测定相同的药代动力学参数,给药剂量与第一次药代动力学试验相同。同时也需要进行抑制物的检测,抑制物检测时间点可考虑选择给药前、ED10-15和ED50-75。
rhFⅨ的效价测定方法应稳定可靠,血浆中rhFⅨ的检测方法应与rhFⅨ效价标定的方法一致,使用不同的检测方法时,需详细描述所使用的方法并进行方法学验证。
药代动力学研究的受试者可继续参加后续确证性临床试验。
4.1.2 确证性临床试验
4.1.2.1 受试者选择
受试者须年龄≥12岁,FⅨ水平≤2%,具有免疫能力(HIV阳性患者的CD4淋巴细胞应>200/μl)。受试者须为HIV阴性,或病毒载量<200粒/μl或<400000拷贝/ml的HIV阳性患者。需要记录受试者的基线情况,包括病程、出血状况、病毒感染状态等内容。
针对手术患者的临床试验,受试者须为曾接受过≥2次手术(包括大手术)的拟择期手术的中重型血友病B受试者(FⅨ水平≤2%),样本量应不少于5名。
如果研究连续输注的用法,需在至少10名拟择期手术的中重型血友病B患者(FⅨ水平≤2%)中开展相关的临床试验。
4.1.2.2 疗效评价
临床试验中可用于评价FⅨ产品有效性的指标主要包括以下四类:
(1)直观评价受试药物预防出血和止血效果的疗效指标
①年化出血率(Annualized Bleeding Rates,ABR):分自发性和创伤性出血以及总的出血,ABR可采用以下公式进行计算:疗效评价期出血次数/(治疗期天数/365.25),当采用ABR作为主要疗效指标时,要考虑疗效评价时长不宜太短,应不少于6个月,对于给药频次较低的长效制品应综合考虑暴露日的问题。
②出血症状和体征改善评分:当出血发作给予治疗时,按照既定的四级评分量表对止血疗效进行评价。评分标准如下表所示。

③靶关节(Target Joints)数:连续6个月内发生≥3次自发性出血的关节为靶关节,而当连续12个月内出血次数≤2次时,则不再为靶关节。
对于以预防性治疗为目的的临床试验,应选择合适的临床指标反映试验药物对关节的保护作用。
(2)血液中FⅨ活性
通过测定血液系统中FⅨ活性,反映输注后FⅨ水平的提升。
①增量回收率(Incremental Recovery):由输注结束后1小时内所测得的FⅨ的峰值活性(以Cmax表示)计算得出,单位为[IU/dL]/[IU/kg],其计算方法如下:
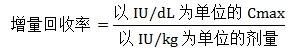
如果基线FⅨ活性值较高,应考虑扣除基线活性。
②FⅨ活性回收率:其计算方法如下:

(3)给药剂量及注射次数
通过记录注射次数、给药剂量(包括平均注射剂量和总用量)评价rhFⅨ在治疗和预防出血中的效果。
(4)生存质量评估量表
目前已有多种评估量表可用于血友病患者生存质量的评估,如儿童生存质量测定量表(The Pediatric Quality of Life Inventory Measurement Models, PedsQL)、血友病关节健康评估表(Haemophilia Joint Health Score, HJHS)等。建议在临床试验过程中,采用经过充分验证的、适合研究人群的量表。
除以上指标外,还可将疗效低于预期(Less-Than-Expected-Therapeutic Effect, LETE)的发生率纳入考察范围,并考虑凝血指标的测定,如活化部分凝血酶原时间(APTT)、血浆凝血酶原时间(PT)、D-二聚体等,以此判断受试者输注rhFⅨ后凝血功能的变化。
临床试验设计应包含按需治疗和预防性治疗的研究。应根据制品的特征和试验目的选择合理的疗效指标。评价按需治疗的疗效时,需要至少包括止血疗效评价指标和反应FⅨ活性两类指标;评价预防性治疗的疗效时,考虑其目的是为了减少出血、避免关节致残,应重点考虑评价年化出血率和靶关节数,并评价预防性治疗过程中rhFⅨ治疗突破性出血的疗效。同时,建议在按需治疗和预防性治疗研究中分析注射次数和给药剂量等信息。
对于手术患者临床疗效的评价,可以包括止血效果、失血和输血需求等情况。
4.1.2.3 安全性评价
rhFⅨ的安全性应关注以下几个方面:免疫原性、超敏反应和其他不良事件。其中抑制物产生、超敏反应是FⅨ的主要不良反应,应予以重点关注。
采用非人类细胞系为表达系统时应考虑可能引入的污染以及制品免疫原性的改变。病毒安全性方面,要根据生产过程中是否引入人或动物血浆蛋白成分而分析其传播传染性病原体的风险。
临床试验期间,需对所有接受rhFⅨ制品的受试者进行包括生命体征在内的安全性评估,对出现的所有不良事件进行记录和上报,并就其与rhFⅨ制品的因果关系、严重性和预期结果进行分析判断。
免疫原性:
rhFⅨ制品的免疫原性须在上市前进行研究,并在上市后进一步研究加以证实。
在凝血因子替代治疗中,血友病B患者产生抑制物的几率低于血友病A患者。在中重型血友病B(FⅨ水平≤2%)患者中,产生抑制物的概率约为4%,研究表明,抑制物的生成通常与FⅨ基因的完全缺失有关。与血友病A患者不同,血友病B患者会伴随抑制物形成而更频繁地发生超敏反应。有文献报道,血友病B患者在接受FⅨ免疫耐受疗法后出现了超敏反应和肾病综合症。
抑制物的发生需要基于临床表现并通过实验室检测加以确认。研究中应关注以下内容:
1)应首先在中重型PTPs受试者中(FⅨ水平≤2%)开展抑制物产生的研究。
2)因超敏反应的发生可能与抑制物相关,应关注试验过程中的超敏反应。
3)建议在rhFⅨ水平恢复至基线时采集样本进行抑制物检测。采样时间的确定还应考虑rhFⅨ的特征(如半衰期延长的rhFⅨ),以避免血样中残留的FⅨ对抑制物测定的影响。
4)FⅨ抑制物的检测建议采用Bethesda检测法或者Nijmegen改进的Bethesda方法进行,并以Bethesda单位(BU)表示。样本检测前,须对检测方法进行充分的方法学验证。若抑制物检测结果呈阳性,则需要重新采集受试者的血样进行复检确认,并在SAE报告中记录采样时间点。
5)抑制物产生定义为Bethesda抑制物滴度≥0.6 BU/ml。将“低滴度”抑制物的阈值定为≥0.6BU/ml,“高滴度”抑制物定为>5BU/ml;
6)应关注影响抑制物测定的因素,如慢性病毒感染(例如HIV、HCV)或狼疮抗凝物等;
7)需要记录受试者的详细情况,如家族史、生活习惯、健康状况、感染情况、治疗的原因、治疗起始日期、治疗类型(按需、预防、连续输注等)。
8)对于出现抑制物的受试者,需记录其FⅨ基因突变类型。
9)临床试验过程中,应监测rhFⅨ活性回收率并观察疗效,若未达到预期,应考虑抑制物形成的可能性。
对于产生抑制物的受试者,应根据受试者情况及临床治疗经验及时给予恰当的治疗,并递交包括抑制物滴度、临床止血效果、累积抑制物发生率和给药天数等在内的完整临床报告。临床试验中应对疑似产生抑制物或已经产生抑制物的受试者的血浆样本进行妥善储存,以便在监管部门需要时再次实施抑制物分析。
超敏反应:
受试者使用rhFⅨ制品后可能会发生超敏反应,该超敏反应可能与抑制物形成有关。当发现超敏反应时,应关注受试者抑制物形成情况。另外,制品中含有的宿主细胞蛋白、生产过程中使用的辅料以及残留物等也可能引起超敏反应。
儿童对FⅨ制品的反应可能与成年人不同,故需要对儿童进行多中心临床试验。在完成至少10名≥12岁的PTPs受试者50EDs治疗,初步了解制品的安全性后,才可开展<12岁受试者的临床试验。
儿童临床研究应从药代动力学开始,药代动力学参数应包括增量回收率、体内半衰期、药时曲线下面积和清除率等。PK试验中,<12岁PTPs受试者至少16名,其中<6岁PTPs受试者不少于6例。在第一次给予受试药物前,应首先了解受试者先前使用其它FⅨ制品的药代动力学信息(包括活性回收率及半衰期等)。考虑到儿童受试者的依从性,可适当减少药代动力学的采样时间点,并根据rhFⅨ的类型(如半衰期延长的rhFⅨ)调整采样时间点。试验过程中应准确记录输注后实际取样的时间点。为保持一致性,建议在中心实验室进行药代动力学试验样本的检测。
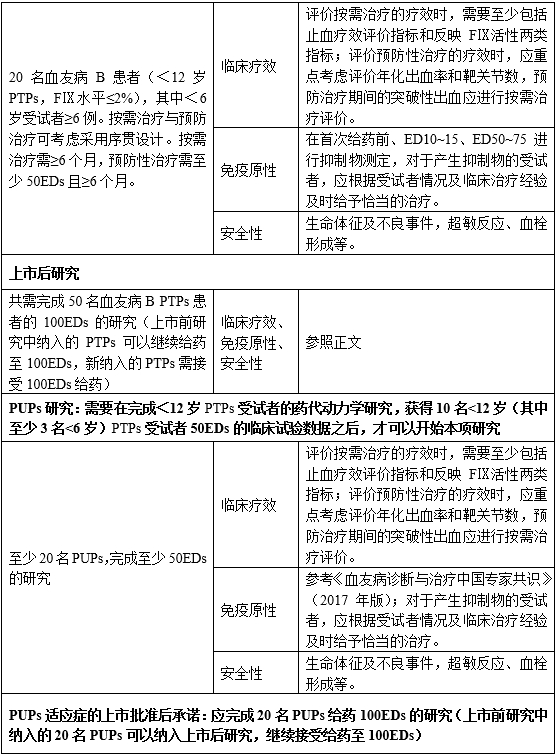
在儿童受试者中的有效性和安全性考察,需至少20名PTPs受试者(FⅨ水平≤2%),其中<6岁PTPs受试者应至少6例。疗效评价时长、疗效指标等的选择,可参考≥12岁PTPs受试者临床研究的考虑。要同时监测治疗过程中rhFⅨ制品的用法用量(预防或按需治疗)和抑制物的发生。对抑制物的考察,可参考4.1.2.3中免疫原性部分。
完成<12岁儿童的上市前研究之后,在上市后研究中可以招募任何年龄的PTPs,但需考虑年龄均衡。
所有的rhFⅨ制品均须进行PUPs人群的临床研究,可在上市前或上市后开展。在获得20名PUPs的有效性和安全性数据前,说明书中的适应症人群中不可包含PUPs。
批准PUPs成为适应症人群的前提是完成至少20名PUPs给药≥50EDs的有效性和安全性评价,并承诺在批准上市后完成20例受试者给药至100EDs的研究。PUPs受试者临床研究及应用过程中抑制物的检测时间点可参考《血友病诊断与治疗中国专家共识》(2017年版)。
PUPs受试者的临床研究,需要在完成<12岁PTPs受试者的药代动力学研究,获得至少10名<12岁PTPs受试者的50EDs数据(其中<6岁PTPs受试者至少3名),才可以开展。
为了收集更多的临床数据,确保上市后常规用药与上市前临床试验结果的长期一致性,需要进行上市后研究。上市后临床研究需考虑上市前临床研究的结果。除有效性和一般安全性外,应特别关注制品的免疫原性、血栓形成和超敏反应情况。
一般来说,上市后研究要考虑国内血友病B患者人群情况。详细了解并记录受试者的日志、记录表等资料信息,包含最近50EDs或最近2年的用药情况,以便确认治疗方式(如预防、按需或手术)。
上市后研究中需至少50名PTPs受试者完成100EDs的给药。研究中可纳入任何年龄的PTPs,纳入的受试者年龄分布需均衡。
关于PUPs的研究,整个临床研究中,包括上市前和上市后,需至少20名PUPs受试者完成100EDs的给药。
一般来说,参加上市前临床研究的受试者可以继续参加上市后研究,对于新招募的受试者,筛选期应检测其抑制物水平。
在上市后研究中,可以纳入免疫耐受诱导(ITI)成功的重度血友病B患者,以获得该患者人群应用rhFⅨ制品的信息。在纳入的受试者中,ITI患者的比例不得高于25%。还可纳入感染HIV、HCV等的血友病B患者,以探索FⅨ制品在该类患者中的有效性和安全性。HIV阳性患者须满足以下条件:CD4淋巴细胞>200/μl,病毒载量<200粒/μl,约400000拷贝/ml。由于目前HIV阳性患者的治疗用药对抑制物的形成或者疗效影响未知,因此临床试验过程中,应记录受试者的基线疾病及相应伴随用药情况。其他受试者,如HCV感染者、血小板水平降低患者、肝功受损患者及凝血功能改变等患者,也应对其疾病状况及伴随用药等相关信息进行记录。
在提交上市申请时,应一并提交上市后临床研究方案及风险管理计划。上市2年后需向有关管理部门提交研究进展报告,包括受试者招募状态和试验进展等信息。在再注册申请时需要提交上市后研究的完整报告。
生产工艺变更可能对rhFⅨ的分子结构和生物学特性产生影响,进而可能影响临床疗效和安全性。如果不能排除上述影响,应考虑开展试验证明生产工艺变更后制品在质量、安全性和疗效方面与变更前制品具有可比性。建议从产品质量考察开始,必要时可通过非临床或临床试验进一步验证。生产工艺变更需开展的研究可参考生产工艺变更相关指导原则。
临床研究可根据工艺变更的具体情况而定,从比较生产工艺变更前后制品的药代动力学试验开始,逐步实施。选择至少12名PTPs受试者进行生产工艺变更前后制品的比较药代动力学试验,受试者纳入标准、给药剂量、药代动力学参数及采样时间等参考4.1.1。受试者要使用生产工艺变更后制品持续预防性治疗6个月,并在3-6个月期间重新进行一次相同的药代动力学试验。
有效性和安全性方面的研究可参考上述第4部分的内容。临床研究数据要足以说明变更后制品的有效性和安全性,根据预期风险,对生产工艺变更前后产品之间的差异进行监测。需特别关注生产工艺变更前后产品的免疫原性变化。
综上,递交申请时需要说明生产工艺变更对制品疗效和安全性可能造成的潜在影响,并对临床试验计划的合理性进行阐述和论证。
风险管理计划(Risk Management Plan, RMP)应当结合产品特点,并基于风险管理计划的一般指导原则进行制定。制定的风险管理计划应包括但不限于本部分论述的内容,可从以下几点进行考虑。
在上市前临床试验中,应根据受试者人群特征、产品特点等内容设置合理的风险管理计划,如受试者出现抑制物后的处理措施等,以保证受试者安全性。
上市后风险管理计划中,需要对未纳入临床试验的人群制定风险管理计划和药物警戒计划。未纳入临床试验的人群主要是基于前期临床试验相关的患者排除标准而得出,该部分人群可能成为rhFⅨ制品的使用人群,但限于临床试验设计而无法从临床试验中获得其使用rhFⅨ制品的信息。
在风险管理计划中应包含已确定风险及非预期风险的监控。已确定的rhFⅨ制品风险主要包括抑制物形成、超敏反应、缺乏药物疗效和血栓形成等。
抑制物形成:
须对已报告的新生或复发的抑制物进行综合分析,并以累计报告的形式在RMP中列出,包括:
1)抑制物报告的来源,如:临床试验、上市后研究、自发报告等。
2)抑制物滴度:如果实验室检测结果呈阳性,需重新采集样本进行复检。样本需妥善保存以备后续检测。
3)产生抑制物的风险分类:如:血友病B严重程度、治疗状态(即PUPs/PTPs)、人凝血因子Ⅸ制品的累计暴露量(总EDs及受试制品的EDs)、基因突变类型、首次接受治疗的年龄、治疗强度等。
4)特殊人群,如:经过手术治疗随后产生抑制物的患者,由一种制品转换为另一制品而引起的特殊风险(例如产生抑制物,缺乏疗效)的患者等。对于使用生产工艺有明显变更的制品的患者,需关注生产工艺变更所带来的风险。
超敏反应:
使用rhFⅨ制品时,可能会发生由宿主细胞蛋白、生产过程中使用的辅料以及残留物等引起的超敏反应,包括局部和全身过敏反应。需关注发生超敏反应的患者,并对其抑制物产生情况进行随访研究。
缺乏药物疗效:
缺乏药物疗效和突破性出血可能是由于抑制物造成的。当发现药物缺乏疗效时,应特别关注抑制物的形成,需要提交药品用量、活性回收率、半衰期、抑制物测定等在内的详细随访信息。
血栓形成:
应对血栓形成事件进行监测并汇报。
1.中华医学会血液学分会血栓与止血学组、中国血友病协作组:血友病诊断与治疗中国专家共识(2017年版)。中华血液学杂志,2016,37(5):364-370.
2.EMA:Guideline on the clinical investigation of recombinant and human plasma-derived factor IX products. 2015和2018(draft).
3.CFDA:药品临床试验质量管理规范(GCP)修订稿。2015.
4.ICH Q5E: Comparability of Biotechnological/Biological Products Subject to Changes in their Manufacturing Process (CPMP/ICH/5721/03). 2004.
5.CFDA:生物类似药研发与评价技术指导原则(试行).2015.
6.CFDA:生物制品上市后变更研究的技术指导原则(征求意见稿).2017.
7.Blanchette VS, Key NS, Ljung LR, et al. Definitions in hemophilia: communication from the SSC of the ISTH. J Thromb Haemost, 2014,12(11):1935–9.
附录一


附录二

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

《海南博鳌乐城国际医疗旅游先行区临床急需进口药品带离先行区使用管理暂行办法》已经3月24日海南博鳌乐城国际医疗旅游先行区领导小组会议审议通过,现印发给你们,请遵照执行

为深入贯彻落实中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),按照国家药品监督管理局《关于扩大医疗器械

附件:血液透析用水处理设备注册审查指导原则(2024年修订版)(2024年第19号).doc血液透析用水处理设备注册审查指导原则(2024年修订版)本指导原则旨在指导注册申请人对血液透析用水处理设备注册申报资料的准备及撰写,同时也为技术审评部门提供参考。本指导原则是对血液透析用水处理设备的一般要求,注册申请人依据产品的具体特性确定其中内容是否适用。若不适用,要具体阐述理由及相应的科学依据,并依据产

国家药监局关于发布免于进行临床评价医疗器械目录的通告(2025年第19号)发布时间:2025-05-13为做好医疗器械注册管理工作,根据《医疗器械注册与备案管理

附件:一次性使用医用冲洗器产品注册审查指导原则(2022年第41号).doc一次性使用医用冲洗器产品注册审查指导原则本指导原则旨在指导注册申请人对一次性使用医用

本指导原则旨在帮助和指导注册申请人对一次性使用腹部穿刺器注册申报资料进行准备,以满足技术审评的基本要求。同时有助于审评机构对该类产品进行科学规范的审评,提高审评工

附件:医用透明质酸钠创面敷料注册审查指导原则(2024年第21号).doc医用透明质酸钠创面敷料注册审查指导原则本指导原则旨在指导注册申请人准备及撰写医用透明质酸钠创面敷料注册申报资料,同时也为技术审评部门审查注册申报资料提供参考。本指导原则是对医用透明质酸钠创面敷料产品的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对

国家药监局器审中心关于发布影像型超声诊断设备(第三类)注册审查指导原则(2023年修订版)的通告(2024年第29号)发布时间:2024-10-14为进一步规范

附件:康复类数字疗法软件产品分类界定指导原则(2025年第27号).doc康复类数字疗法软件产品分类界定指导原则一、目的为指导康复类数字疗法软件产品管理属性和管

国家药监局药审中心关于发布《抗肿瘤药物临床试验中SUSAR分析与处理技术指导原则》的通告(2024年第42号) 发布日期:20241010
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台