山东省医疗器械工艺用水现场检查指南(鲁药监械〔2021〕35号)
为规范医疗器械现场检查,提升检查员现场检查能力,指导检查员对医疗器械生产企业工艺用水控制情况的检查,提高企业工艺用水质量安全保证水平,依据《医疗器械监督管理条例》
来源:医疗器械注册代办 发布日期:2014-05-30 阅读量:次
附件:医疗器械产品技术要求编写指导原则(2014年第9号).doc➡医疗器械产品技术要求编写指导原则(2022年第8号)

(2014年第9号)
根据《医疗器械监督管理条例》等相关规定,制定本指导原则。
(一)医疗器械产品技术要求的编制应符合国家相关法律法规。
(二)医疗器械产品技术要求中应采用规范、通用的术语。如涉及特殊的术语,需提供明确定义,并写到“4.术语”部分。
(三)医疗器械产品技术要求中的检验方法各项内容的编号原则上应和性能指标各项内容的编号相对应。
(四)医疗器械产品技术要求中的文字、数字、公式、单位、符号、图表等应符合标准化要求。
(五)如医疗器械产品技术要求中的内容引用国家标准、行业标准或中国药典,应保证其有效性,并注明相应标准的编号和年号以及中国药典的版本号。
医疗器械产品技术要求的内容应符合以下要求:
(一)产品名称。产品技术要求中的产品名称应使用中文,并与申请注册(备案)的中文产品名称相一致。
(二)产品型号/规格及其划分说明。产品技术要求中应明确产品型号和/或规格,以及其划分的说明。
对同一注册单元中存在多种型号和/或规格的产品,应明确各型号及各规格之间的所有区别(必要时可附相应图示进行说明)。
对于型号/规格的表述文本较大的可以附录形式提供。
(三)性能指标。
1.产品技术要求中的性能指标是指可进行客观判定的成品的功能性、安全性指标以及质量控制相关的其他指标。产品设计开发中的评价性内容(例如生物相容性评价)原则上不在产品技术要求中制定。
2.产品技术要求中性能指标的制定应参考相关国家标准/行业标准并结合具体产品的设计特性、预期用途和质量控制水平且不应低于产品适用的强制性国家标准/行业标准。
3.产品技术要求中的性能指标应明确具体要求,不应以“见随附资料”、“按供货合同”等形式提供。
(四)检验方法。检验方法的制定应与相应的性能指标相适应。应优先考虑采用公认的或已颁布的标准检验方法。检验方法的制定需保证具有可重现性和可操作性,需要时明确样品的制备方法,必要时可附相应图示进行说明,文本较大的可以附录形式提供。
对于体外诊断试剂类产品,检验方法中还应明确说明采用的参考品/标准品、样本制备方法、使用的试剂批次和数量、试验次数、计算方法。
(五)对于第三类体外诊断试剂类产品,产品技术要求中应以附录形式明确主要原材料、生产工艺及半成品要求。
(六)医疗器械产品技术要求编号为相应的注册证号(备案号)。拟注册(备案)的产品技术要求编号可留空。
医疗器械产品技术要求格式见附件。
附件:医疗器械产品技术要求格式
附件
医疗器械产品技术要求编号(宋体小四号,加粗):
1.产品型号/规格及其划分说明(宋体小四号,加粗)(如适用)
1.1 ……(宋体小四号)
1.1.1 ……
……
2.性能指标(宋体小四号,加粗)
2.1 ……(宋体小四号)
2.1.1 ……
……
3.检验方法(宋体小四号,加粗)
3.1 ……(宋体小四号)
3.1.1 ……
……
4.术语(宋体小四号,加粗)(如适用)
4.1 ……(宋体小四号)
4.2 ……
……
(分页)
附录A……(宋体小四号,加粗)(如适用)
1.……(宋体小四号)
1.1 ……

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
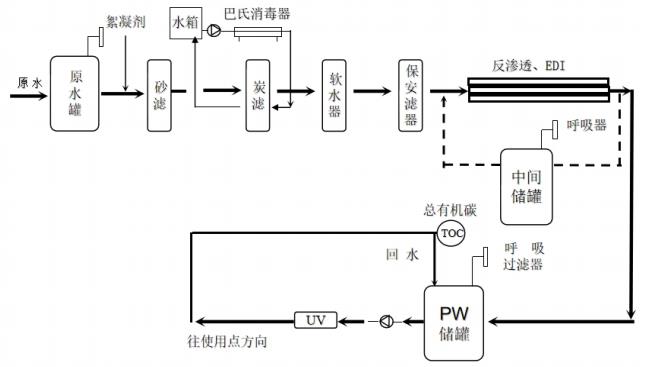
为规范医疗器械现场检查,提升检查员现场检查能力,指导检查员对医疗器械生产企业工艺用水控制情况的检查,提高企业工艺用水质量安全保证水平,依据《医疗器械监督管理条例》

《海南博鳌乐城国际医疗旅游先行区临床急需进口药品带离先行区使用管理暂行办法》已经3月24日海南博鳌乐城国际医疗旅游先行区领导小组会议审议通过,现印发给你们,请遵照执行

为深入贯彻落实中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),按照国家药品监督管理局《关于扩大医疗器械
《海南博鳌乐城国际医疗旅游先行区医疗机构制剂调剂使用管理暂行办法》已经3月24日海南博鳌乐城国际医疗旅游先行区领导小组会议审议通过,现印发给你们,请遵照执行。

为规范医疗器械注册人跨区域委托生产的监督管理,推进长江三角洲区域医疗器械跨区域监管,根据《中共中央办公厅国务院办公厅关于深化审评审批制度改革鼓励药品医疗器械创新的意见》《

附件:血液透析用水处理设备注册审查指导原则(2024年修订版)(2024年第19号).doc血液透析用水处理设备注册审查指导原则(2024年修订版)本指导原则旨在指导注册申请人对血液透析用水处理设备注册申报资料的准备及撰写,同时也为技术审评部门提供参考。本指导原则是对血液透析用水处理设备的一般要求,注册申请人依据产品的具体特性确定其中内容是否适用。若不适用,要具体阐述理由及相应的科学依据,并依据产

国家药监局关于发布免于进行临床评价医疗器械目录的通告(2025年第19号)发布时间:2025-05-13为做好医疗器械注册管理工作,根据《医疗器械注册与备案管理

关于发布医疗器械质量管理体系年度自查报告编写指南的通告(2022年第13号)发布时间:2022-03-24为加强医疗器械生产监管,保障医疗器械安全有效,根据《医

附件:一次性使用医用冲洗器产品注册审查指导原则(2022年第41号).doc一次性使用医用冲洗器产品注册审查指导原则本指导原则旨在指导注册申请人对一次性使用医用

为加强医疗器械生产监督管理,规范医疗器械生产质量管理,根据《医疗器械监督管理条例》(国务院令650号)、《医疗器械生产监督管理办法》(国家食品药品监督管理总局令第7号)
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台