灭菌级和非灭菌级外科口罩区别
新冠疫情大流行,人们佩戴口罩抵御病毒成了一种常态,吃饭的时候和同事开玩笑,以后脱下口罩不知道会不会习惯。医用外科口罩外包装上通常标明灭菌级和非灭菌级,你知道两者的
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
引言:受肺炎疫情的影响,医用口罩成了大家比较关心的医疗器械之一,近期咨询口罩相关产品医疗器械注册、医疗器械经营许可及二类医疗器械经营备案的事项较多,一直也在想写一篇文章,为大家介绍一下口罩相关知识。

口罩是一种卫生用品,一般指戴在口鼻部位用于过滤进入口鼻的空气,以达到阻挡有害的气体、气味、飞沫进出佩戴者口鼻的用具,以纱布或纸等制成。口罩对进入肺部的空气有一定的过滤作用,在呼吸道传染病流行时,在粉尘等污染的环境中作业时,戴口罩具有非常好的作用。
根据适用标准不同,口罩可分为医用口罩、自吸过滤式防颗粒物呼吸器、普通脱脂纱布口罩三类。
医用口罩分为医用防护口罩、医用外科口罩、普通医用口罩(一次性使用医用口罩)。
1. 医用防护口罩,符合国家强制性标准GB19083-2010《医用防护口罩技术要求》相关要求。适用于医疗环境工作下,过滤空气中的颗粒物,阻挡飞沫、血液、体液、分泌物等的自吸过滤式医用防护口罩。医用防护口罩按照GB19083采用“1级”“2级”和“3级”的说法来表示过滤效率等级。GB19083还提出了“合成血液穿透”的要求及“表面抗湿性”的参数要求,明确了医用防护口罩对血液体液等液体的防护效果。一般1级就可以达到N95/KN95的过滤效率。

另外,大家目前关注的N95口罩,是符合美国国家职业安全研究所(NIOSH)的NIOSH42 CFR84-1995标准要求,包括N95、N99、N100以及R系列、P系列等。达到医用标准的N95口罩可以用于医疗机构防护用。3M公司生产的符合N95 标准的口罩有10余种,但其中只有1860(儿童版为1860S)和9132两种型号是医用防护口罩,另外2042F及2042FP型号可作为医用外科口罩。

2. 医用外科口罩,符合医药行业标准YY0469-2011《医用外科口罩技术要求》相关要求,适用于临床医务人员在有创操作等过程中所佩戴的一次性口罩。用于覆盖住使用者的口、鼻及下颚,为防止病原体微生物,体液、颗粒物等直接透过提供物理保障。该类口罩一般对非油性颗粒的过滤效率应达到30%以上,对细菌的过滤效率要达到95%以上,此外,对合成血液穿透性的要求,一般会将口罩分为三层:内部吸水层,中间过滤层,外面防水层,每一层都有特别的作用。
3. 普通医用口罩,符合相关注册产品标准(YZB)或医药行业推荐性标准YY/T 0969-2013《一次性使用医用口罩》相关要求,适用于覆盖使用者的口、鼻及下颚,用于普通医疗环境中佩戴,阻隔口腔和鼻腔呼出或喷出污染物的一次性口罩,一般无法保证对病原微生物、粉尘的过滤性,在医院中一般用于常规护理,用于阻隔医护人员与患者之间的日常交叉感染。

1. KN口罩、KP口罩。符合国家强制性标准GB2626-2006《呼吸防护用品自吸过滤式防颗粒物呼吸器》相关要求,适用于防护各类颗粒物的自吸过滤式防护用品,不适用于防护有害气体和蒸汽,不适用于缺氧环境、水下作业、逃生和消防用呼吸防护用品。其中KP口罩主要用于化工行业,不适用于民用。KN口罩根据其对非油性颗粒物的过滤性能,分为KN90、KN95、KN100。其中KN95口罩对非油性颗粒物的过滤性能达到95%以上,但是KN口罩、KP口罩由于没有防渗透的要求,不能用于医疗机构防护用。

2. 韩国KF94口罩。该类口罩是韩国生产制定的标准,该标准下的口罩对于直径0.4μm的颗粒物过滤率大于94%,因此KF94口罩同KN95类似,KF94口罩并不是针对医用标准,不能用于医疗机构防护用。
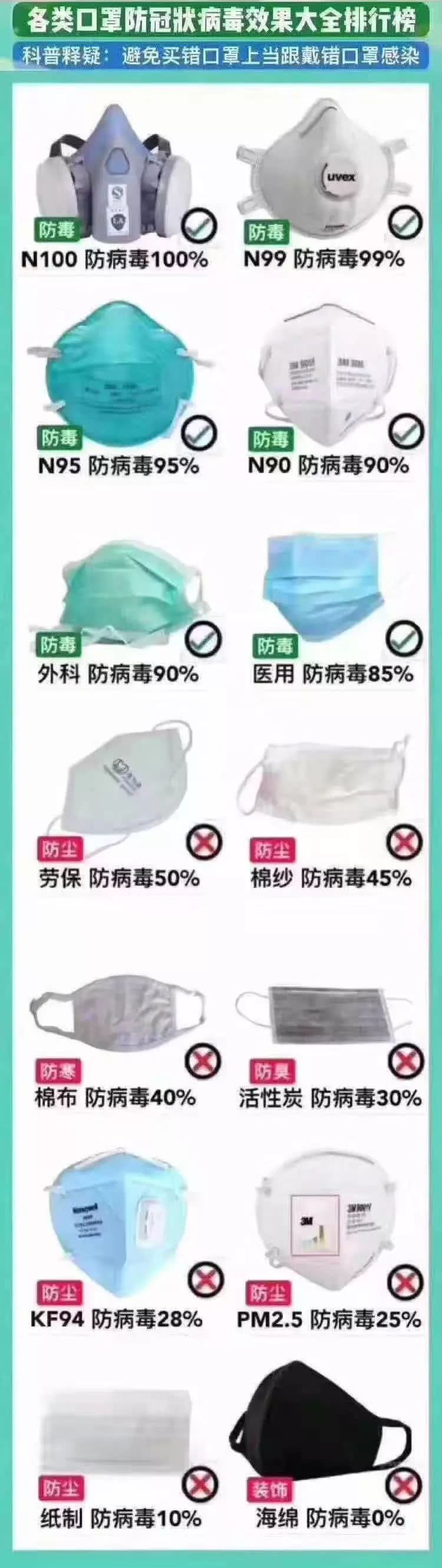
附:各类口罩防新冠病毒效果大全排行榜

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

新冠疫情大流行,人们佩戴口罩抵御病毒成了一种常态,吃饭的时候和同事开玩笑,以后脱下口罩不知道会不会习惯。医用外科口罩外包装上通常标明灭菌级和非灭菌级,你知道两者的

2019-12-01药物临床试验机构(简称机构)开始实行备案管理。本文结合机构备案平台构建思路,着重介绍了备案平台的结构组成以及相关要求,梳理了机构备案过程中的常见问题,对机构

任何国家医疗器械产品出口澳大利亚,需经历TGA注册,以下是关于澳大利亚医疗器械注册知识点,简单了解一下,文中大致概括了注册全流程,未标明细节,如有产品需要澳大利亚注册

MDR 2017/745号法规附录VIII中详定了22条分类规则。根据器械的预期用途和其固有风险,医疗器械应分为:I、IIa、IIb和III类。"

说真的,最近除了口罩,还是口罩。现在朋友圈问最多的,就是口罩能不能出口啊,需要什么资质和证明啊……昨天有人转发一文章给我,说口罩被扣的,因为CE认证不被国外海关认可,

二类医疗器械是指,对其安全性、有效性应当加以控制的医疗器械。包括X线拍片机、B超、显微镜、生化仪等都属于二类医疗器械。下面我把第二类医疗器械的包括哪些产品分享如下,大

根据《中华人民共和国传染病防治法》第七十八条的规定,消毒是指用化学、物理、生物的方法杀灭或者消除环境中的病原微生物。 在作用目的上,它是一种防病的产品,而不是

开办口罩厂要办什么手续?要投资多少钱?印度疫情继续肆虐,似乎已成为全球第N波新冠疫情的风暴中心,多国也限制印度人员进入。口罩依旧是人类防范传染病最常见的手段,口罩在当前大

药物临床试验资料是临床试验项目的启动过程及临床实施情况的真实记录。临床试验资料管理贯穿于整个药物临床试验过程中,临床试验资料全面记录国家药品监督管理部门与研究中心

随着中国疫情得到缓解,而境外特别是欧盟疫情防控形势严峻,欧盟对口罩的需求上升,而作为口罩生产大国,口罩企业继“民转医”经历之后,将迅速转入“医转外”,“民转外”的
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台