
进口二类医疗器械注册证(延续注册)服务
根据《医疗器械监督管理条例》和《进口医疗器械延续注册审批服务指南》的规定,医疗器械注册证有效期为5年。有效期届满需要延续注册的,应当在有效期届满6个月前向原注册部门...
服务价:¥电议
好评系数:

根据《医疗器械监督管理条例》和《进口医疗器械延续注册审批服务指南》的规定,医疗器械注册证有效期为5年。有效期届满需要延续注册的,应当在有效期届满6个月前向原注册部门提出延续注册的申请。提出进口医疗器械注册证延续的申请人应为境外依法进行登记的生产企业,且该医疗器械已在注册申请人注册地或者生产地址所在国家(地区)已获准上市销售。
接到延续注册申请的食品药品监督管理部门应当在医疗器械注册证有效期届满前作出准予延续的决定。逾期未作决定的,视为准予延续。
有下列情形之一的,不予延续注册:
(一)注册人未在规定期限内提出延续注册申请的;
(二)医疗器械强制性标准已经修订,申请延续注册的医疗器械不能达到新要求的;
(三)对用于治疗罕见疾病以及应对突发公共卫生事件急需的医疗器械,未在规定期限内完成医疗器械注册证载明事项的。
进口二类医疗器械延续注册申报资料
1、申请表;
2、证明性文件(由境外注册人提供);
(1)境外注册人应当提交其在中国指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明复印件。
注:进口医疗器械延续注册时,不需要提供注册人注册地或者生产地址所在国家(地区)批准产品上市销售的证明文件。
3、关于产品没有变化的声明(注册人提供);
4、原医疗器械注册证及其附件的复印件、历次医疗器械注册变更文件复印件;
5、注册证有效期内产品分析报告;
(1)产品临床应用情况,用户投诉情况及采取的措施。
(2)医疗器械不良事件汇总分析评价报告,报告应对本产品上市后发生的可疑不良事件列表,说明在每一种情况下生产企业采取的处理和解决方案。对上述不良事件进行分析评价,阐明不良事件发生的原因并对其安全性、有效性的影响予以说明。
(3)产品市场情况说明。
(4)产品监督抽验情况(如有)。
(5)如上市后发生了召回,应当说明召回原因、过程和处理结果。
(6)原医疗器械注册证中载明要求继续完成工作的,应当提供相关总结报告,并附相应资料。
6、产品检验报告;
如医疗器械强制性标准已经修订,应提供产品能够达到新要求的产品检验报告。产品检验报告可以是自检报告、委托检验报告或符合强制性标准实施通知规定的检验报告。其中,委托检验报告应由具有医疗器械检验资质的医疗器械检验机构出具。
7、符合性声明;
(1)注册人声明本产品符合《医疗器械注册管理办法》和相关法规的要求;声明本产品符合现行国家标准、行业标准,并提供符合标准的清单。
(2)所提交资料真实性的自我保证声明(进口产品由注册人和代理人分别出具)。
8、其他
如在原注册证有效期内发生了涉及产品技术要求变更的,应当提交依据注册变更文件修改的产品技术要求一式两份。
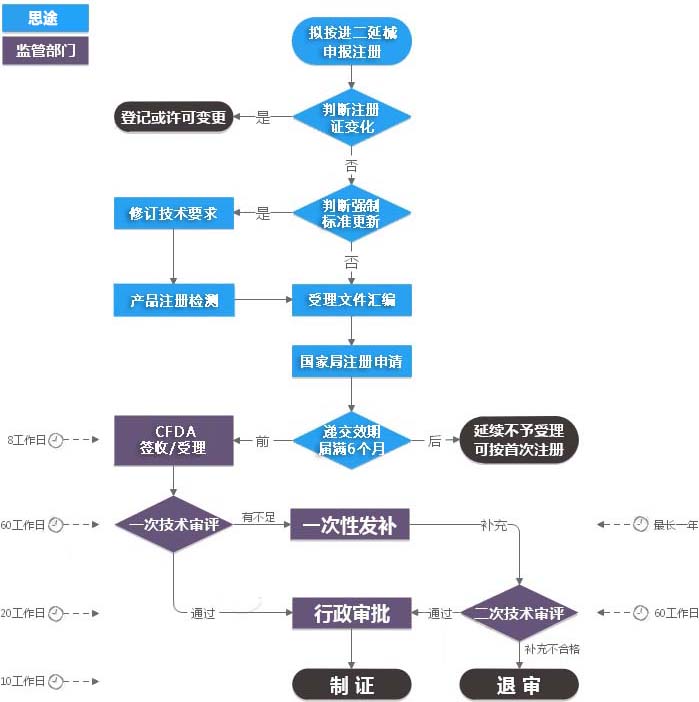
办理流程图

进口二类医疗器械注册证(延续注册)服务流程
进口二类医疗器械注册证(延续注册)收费标准
| 主管部门 | 管理类别 | 首次注册 | 注册变更 | 延续注册 (五年一次) | 临床试验申请费 (高风险医疗器械) | 相关文件 | 实施日期 | ||
|---|---|---|---|---|---|---|---|---|---|
| 国 家 局 | 境外 | Ⅱ | 21.09 | 4.2 | 4.08 | / | 国家局2015年第53号 | 2015/5/27 | |
进口二类医疗器械注册证(延续注册)办理依据
| 文件名称 | 文号 |
|---|---|
| 《医疗器械监督管理条例》 | 650号文件 |
| 《医疗器械注册管理办法》 | 药监总局令4号 |
| 《医疗器械说明书和标签管理规定》 | 药监总局令6号 |
| 《医疗器械临床试验质量管理规范》 | 药监总局令25号 |
| 《医疗器械生产监督管理办法》 | 药监总局令7号 |
| 《医疗器械经营监督管理办法》 | 药监总局令8号 |
| 《医疗器械分类规则》 | 药监总局令15号 |
进口二类医疗器械注册证(延续注册)服务周期
立项阶段
预算、合同、考虑期,1个月。
受理前资料准备
考虑检测平均消耗6个月,视产品情况有所变化,如无强标更新,则可免除检测。
如需精算请联络思途。(免临床目录产品除外。)
注册资料编制可与检测并行。
受理后
CFDA法定消耗预算8个月。(158工日,20工日/月,不计节假,与首次注册一致。)
发补时限0~12个月,考虑平均时间6个月。视产品首次申报资料情况而定。
预算合计
进口二类医疗器械延续注册,预算应至少15~21个月以上。
进口二类医疗器械注册证(延续注册)推荐服务
| 进口二类医疗器械注册服务 | 进口三类医疗器械注册服务 |
| 医疗器械优先审批程序咨询 | 进口创新医疗器械申报服务 |
| 医疗器械临床试验外包服务 |
- 上一篇: 第三类医疗器械注册证(延续注册)服务
- 下一篇: 进口第三类医疗器械注册证(延续注册)服务
 最新文章
最新文章 2024-05-16
2024-05-16 2024-05-15
2024-05-15 2024-05-15
2024-05-15 2024-05-13
2024-05-13 2024-05-13
2024-05-13八年
医疗器械服务经验
-
多一份参考,总有益处
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台
- 在线咨询
- 在线客服
- 服务热线
服务热线
186-0382-3910
- 微信咨询

- 返回顶部









 豫公网安备 41010202003160号
豫公网安备 41010202003160号