7S管理在临床试验用药品管理中的应用
发布日期:2023-10-10 阅读量:次
导读:为提高试验用药品的管理水平,应用7S管理模式规范本院中心药房试验用药品的管理。区域划分明确,分验收区、保存区和退回区,保存区分常温区、阴凉区和冷藏区。设置专业药品管理员,实行专项专册专人管理试验用药品,试验用药品统一接收,严格区分机构、专业存放试验用药品。严格落实日常维护和定期保养工作。加强药品管理员培训,增强GCP意识,提高药品管理能力。购置自动化温度、湿度监控设备,实现全天候温度、湿度监控。缩减管理环节,降低管理成本。7S管理模式的应用使本院中心药房分区更趋合理,人员设置与职责分工更明确,试验用药品的管理更科学、规范。
试验用药品是指用于临床试验中的试验药物、对照药品或安慰剂[1]。试验用药品作为整个临床试验的核心环节,其管理规范与否,对受试者的安全性及试验结果的可靠性起至关重要的作用。本文从本院中心药房试验用药品管理体系着手,探讨如何将7S管理与中心药房试验用药品管理结合,并提出具体实施方法。
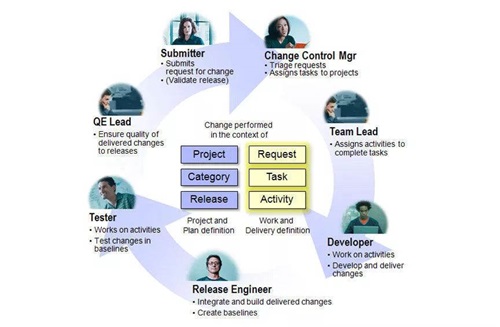
7S管理的起源
7S管理是一种起源于日本的企业现场管理方法,在整理(seiri)、整顿(seiton)、清扫(seiso)、清洁(seiketsu)、素养(shitsuke)5S管理的基础上,结合现代企业管理的需求加上安全(safety)和节约(save),推出7S管理的理念,因其古罗马发音均以“S”开头,简称为7S管理[2]。
7S管理的基本内容
整理(1S):区分必要和非必要,将非必要的清除掉,把“空间” 腾出来活用。
整顿(2S):要用的东西依规定定位、定量摆放整齐,明确标示,不用浪费时间找东西。
清扫(3S):清除工作场所内的脏污,并防止污染的发生,保持工作场所干净明亮。
清洁(4S):将整理、整顿、清扫工作制度化、规范化,通过制度化来维持成果。
素养(5S):工作人员依制度和标准做事,养成工作认真的习惯,全面提升工作人员的职业素养。
安全(6S):管理上建立健全安全管理制度,配置适当的工作人员进行监督,及时消除不合安全规定的因素。
节约(7S):对时间和现场的空间、资源等合理利用,减少人力、成本、空间、时间、库存、物料消耗等因素,养成节约习惯。
7S管理推行整理、整顿、清扫来强化管理,制订相应的制度和标准来规范工作习惯,进一步提高人员素养,最终达到提高管理水平的目的[3]。7S管理是一套目的明确、简单高效、易于理解的管理体系,对提高试验用药品的管理水平具有重要作用。
试验用药品的特点、管理现状及存在的问题
2020版《药物临床试验质量管理规范》第四章第二十一条&第五章第四十五条明确提出:研究者和临床试验机构对申办者提供的试验用药品有管理责任;研究者和临床试验机构应当指派有资格的药师或者其他人员管理试验用药品;保存试验用药品的运输、接收、分发、回收和销毁记录;申办者负责向研究者和临床试验机构提供试验用药品等[1]。
机构成立初期,因中心药房人员不足、设备简单、空间有限等因素,致使本机构试验用药品管理存在以下几点问题:
(1)未明确划分验收区、保存区与退回区,且未将保存区细分;
(2)无专项、专册、专人管理试验用药品资料;
(3)未严格区分机构、专业存放试验用药品;
(4)未严格落实药房日常维护、保养工作;
(5)无全天候、自动化温湿度监控设备;
(6)未严格落实专业管理流程等。
7S管理在中心药房试验用药品管理中的运用
1 整理(1S)的运用
整理之前,中心药房未明确划分区域,药物接收、保存、回收均在中心药房完成。整理之后,在不违反药品存储的基本原则前提下,根据中心药房的实际面积与结构,将中心药房明确划分为验收区、保存区和退回区[4,5]。保存区根据保存要求划分为常温区、阴凉区和冷藏区。据此,中心药房分区更明确,功能定位清晰。
2 整顿(2S)的运用
2.1 设置专职药品管理员
临床试验用药品的规范管理与正确使用是临床试验质量保证的关键环节之一,也是药物临床试验质量管理规范(GCP)核心内容。机构设置专职药品管理员,确保试验药品管理到位、使用正确[6]。在项目启动前,机构专职药品管理员和项目药品管理员必须接受申办方的试验用药品专项培训,所有项目的试验用药品及相关物品均由机构专职药品管理员负责统一接收、验收、管理或转交,建立项目专用文件夹,完善出入库总台帐。机构药品管理员负责机构试验用药品管理相关的培训,并不断完善与机构相适应的《药物临床试验用药品管理制度》和《药物临床试验机构药品管理员职责》。
2.2 专业科室根据项目需求设置项目药品管理员
机构根据项目试验用药品的实际使用要求,如时效性要求高的危急重疾病试验用、高频率试验用、连续长时间住院注射试验用和其他特殊要求试验用等,机构与主要研究者(PI)在项目接洽初期就共同商定,设置项目药品管理员及具体人员[6],以利于专业科室充分准备试验用药品的保存空间,避免空间不足;让药品管理员有更充足的时间了解项目试验用药品的管理特点,接受试验用药品管理培训,增强GCP意识,提高药品管理能力。
2.3 试验用药品的保存
项目试验用药品在机构中心药房统一接收管理,按照存放要求分区存储。依项目先后顺序整理摆放,在试验用药品存储位置外张贴标示药物名称、有限期、保存条件等内容的便签纸。试验用药品的统一保存,具有不可替代的优势,但是这种管理方式并不能满足所有试验项目。试验用药品在科室保存期间,机构药品管理员定期去科室对其保存情况进行检查,对科室药品管理员进行培训,保证试验用药品在科室保存的安全性[7]。
2.4 试验用药品文件保存
在项目运行全过程中,药品管理员按照项目设置专用文件夹保存试验用药品相关的运输记录单,温度记录单,试验用药品交接清单,药物库存、发放、回收、返回表等文件,直至项目结束,整理归档时一起合并项目资料进行归档。
3 清扫(3S)的运用
中心药房定期进行地面清扫,对药柜、冰箱、阴凉柜进行擦拭,试验用药品外包装保持干净。清除工作场所内的脏污,防止污染的发生,保持工作场所干净明亮。
4 清洁(4S)的运用
根据整理、整顿、清扫工作内容,机构办公室制订试验用药品管理相关制度及标准操作规程(SOP),制订具体详细的可操作性工作流程。将整理、整顿、清扫工作制度化、规范化,通过制度化来维持成果。
5 素养(5S)的运用
以上四点构成了药品管理员的外在素养,内在素养的培养则有赖于行为规范和规章制度的落实。药品管理员严格按照药物管理相关法律法规、机构制度及SOP行事。机构药品管理员上岗前须取得药师资格,获得GCP资格证书,经项目PI授权才能上岗管理试验用药品。药品管理员不定期参加药物临床试验有关培训,提高专业素养[8]。项目启动之前,药品管理员必须进行项目药物管理培训[9]。工作人员依制度和标准做事,养成工作认真严谨的习惯,提升职业素养。
6 安全(6S)的运用
6.1 试验用药品的接收
机构药品管理员核对试验用药品运送过程的温度记录、质量报告单、外包装、药物批号、名称、规格、剂型、有效期、厂家及数量等信息,确保中心药房入库试验用药品的合格。
6.2 试验用药品的养护
整理之前,中心药房无专职药品管理员,试验用药品养护不定期进行。整理之后,药品管理员每月对试验用药品进行一次养护,内容包括:药物数量清点、药物总台账核对、近效期药品登记。药物数量不充足的情况下提前一个月告知申办方邮寄药物,保证试验用药品数量充足;临近3个月过期药物,
通知申办方及时运输新药物替换过期药物,确保受试者试验用药品在有效期内使用。
6.3 试验用药品统一退回
科室剩余药物及机构剩余药物统一由机构药品管理员按照SOP退还给申办方,保存退回明细清单,确保试验用药品完整退回。
6.4 安装温控系统
在医院的大力支持下,中心药房配置温控系统,药品管理员使用手机App即可实现试验用药品的动态监控,使本院临床试验用药品温度管理实现了信息化、自动化、全天候的管理模式,降低了人为管理误差,提升了管理质量,推动了临床试验用药品管理规范高效运行。
6.5 超温试验用药品的处置
药品管理员接到或发现试验用药品超温信息时,第一时间邮件通知申办方,微信或电话通知研究者暂停领取超温保存的试验用药品。依据相关制度及SOP,协助申办方向机构伦理委员会报告保存超温的具体情况。再根据其意见,协助申办方规范处理保存超温所涉及的药品。
7 节约(7S)的运用
机构设专职药品管理员1名,兼职药品管理员1名,减少科室药品管理人员数量。受试者为门诊患者时,受试者凭处方到中心药房领取试验用药物。受试者为住院患者或需节假日用药时,由项目药品管理员凭处方或药物领取单提前到中心药房依据项目药品发放要求领取试验用药品至专业科室保存,减少药房的人力,节省管理成本[5]。
结语
试验用药品的管理是药物临床试验中尤为重要的环节之一,随着越来越多的临床研究项目在本院的开展,我们需要不断提高试验用药品管理能力与管理水平。将7S管理应用于本院药物临床试验机构中心药房,使试验用药品管理中存在的不合理、不规范等问题得到了解决。本院中心药房分区更趋合理,人员设置与职责分工更加清晰明确,管理人员GCP意识得到明显提升,基本完善了本院中心药房试验用药品的管理体系,提高了本院临床试验机构中心药房试验用药品管理水平。
参考文献
[1]国家食品药品监督管理局. 药物临床试验质量管理规范[J]. 中国新药与临床杂志,2020,23(1):S1-S5.
[2]马奔. 浅谈7S管理法在医院后勤管理中的应用[J]. 中国管理信息化,2017,20(11):62-63.
[3]崔宝双. 7S管理在新闻传播学实验室中的应用研究[J]. 实验科学与技术,2016,14(3):208-211.
[4]王晨静,柳艳平,李欣,等. 药物临床试验过程中研究药物的管理特点[J]. 中国临床药理学杂志,2016,32(9):858-860.
[5]王槐芾. 我院药物临床试验机构药房药品管理实践体会[J]. 中国药房,2015,26(28):3909-3911.
[6]肖妤,曾代文,严晓梁,等. 由我国临床试验用药物管理存在的问题引发的思考[J]. 实用医院临床杂志,2012,9(1):167-169.
[7]杨忠奇,赖育健,吴波林,等. 药物临床试验药物管理·广东共识(2014年)[J]. 今日药学,2015,25(2):75-76.
[8]张靖. 加强我国药物临床试验机构建设的思考与对策[J]. 中国新药与临床杂志,2018,37(6):337-341.
[9]刘峰,邓贵新,李雪芹,等. 试验药物管理中存在的问题及对策探讨[J]. 中国医药导报,2017,14(20):128-131.
作者:赵想玲,夏勇,闵捷,汪亦奇,李刚,郭飘飘(南昌市第三医院)
选自:中国新药与临床杂志 2019年3月 第38卷 第3期 144-147

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享





 豫公网安备 41010202003160号
豫公网安备 41010202003160号