「申报指引」医疗器械唯一标识(UDI)数据申报操作步骤及相关说明
发布日期:2023-10-10 阅读量:次
废话不多说,直接切入正题。

一、医疗器械唯一标识数据申报操作步骤
1.网上办事大厅的入口,及注册、登录的操作步骤
1.1打开登录网址
https://www.nmpa.gov.cn/
1.2点击网上办事大厅
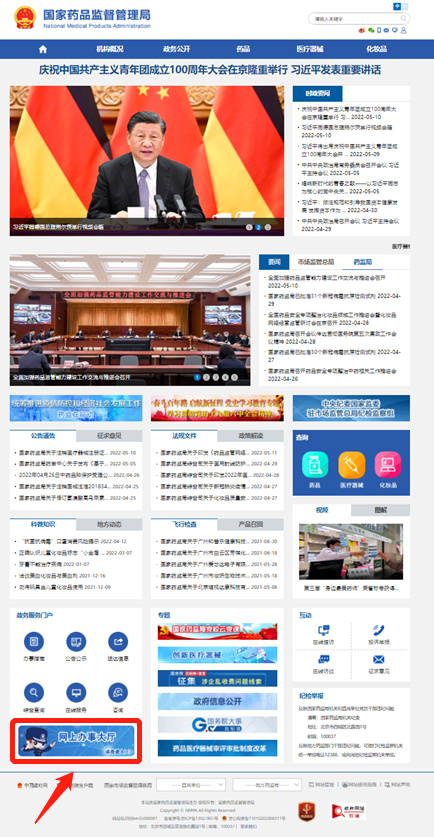
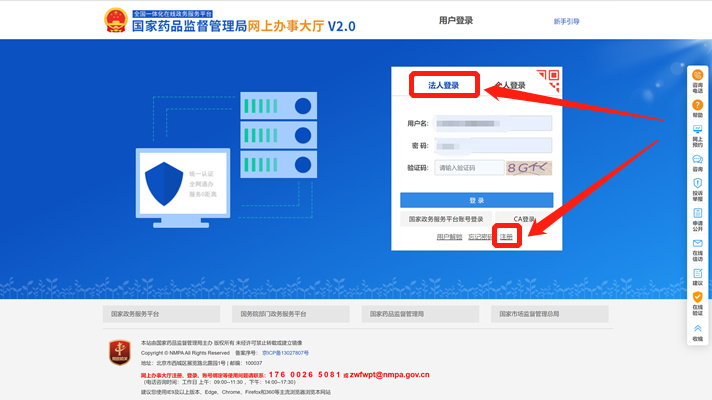
1.3点击法人登录-注册
1.4如实填写相关信息及上传附件
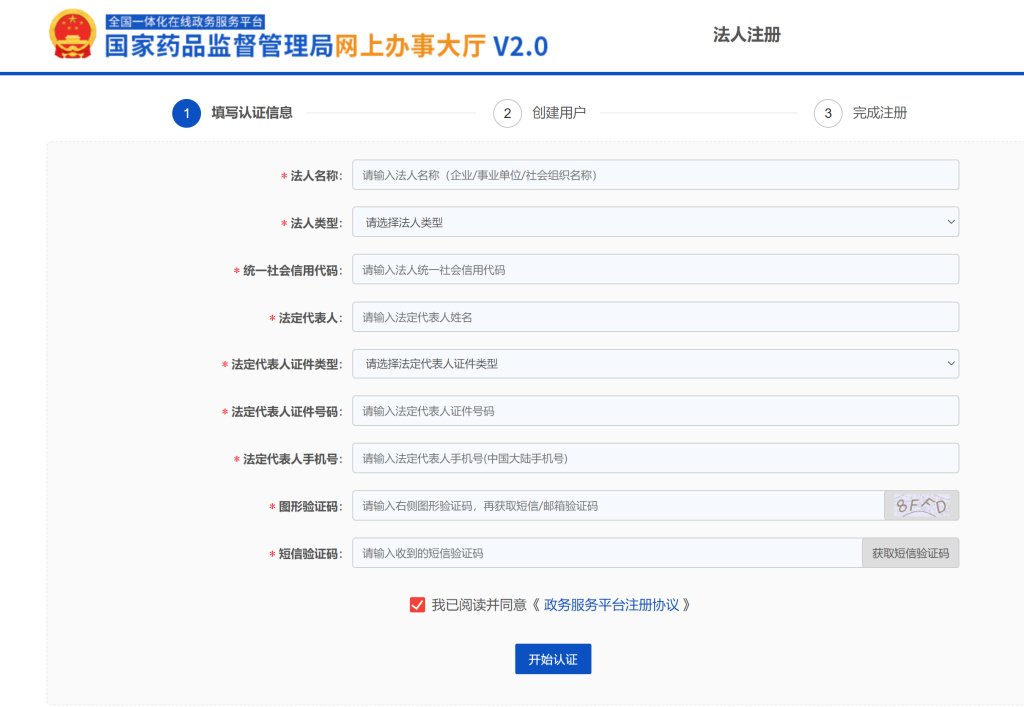
https://zwfw.nmpa.gov.cn/web/index/help#reg
(注册帮助引导)
1.5点击法人登录-登录
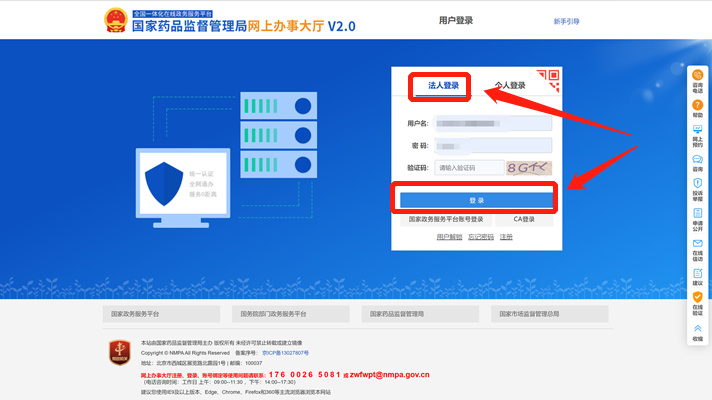
2.医疗器械唯一标识管理信息系统的登入步骤
2.1点击法人服务

2.2选择分类:医疗器械
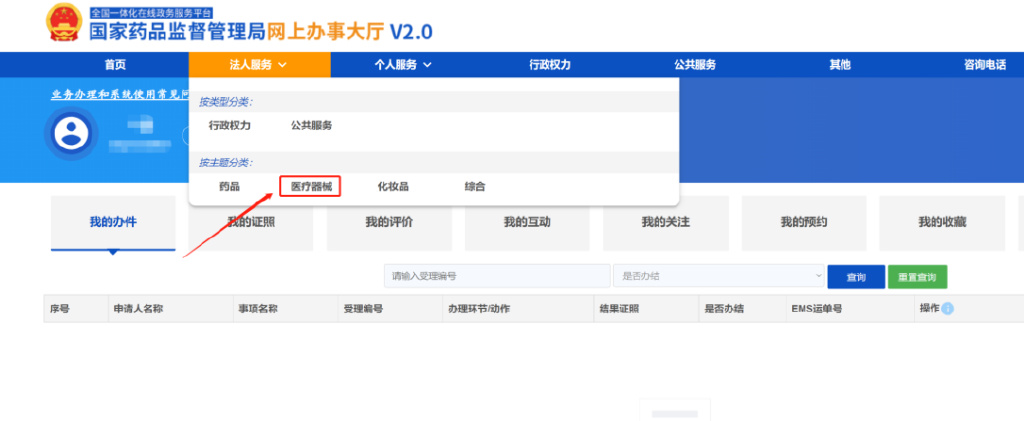
2.3选择*31.医疗器械产品标识申报,点击在线办理
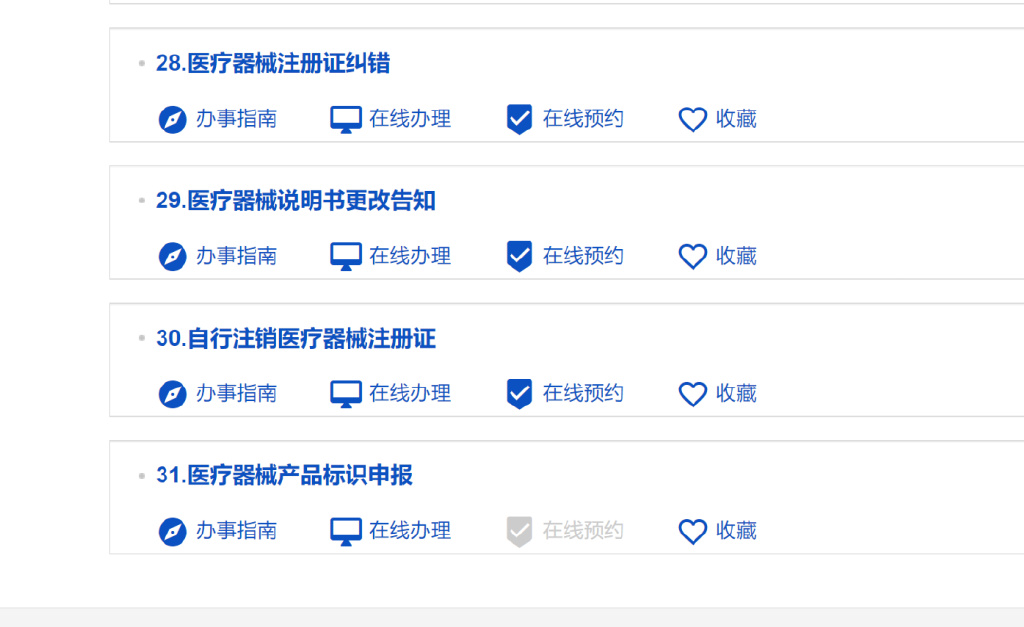
3.医疗器械唯一标识管理信息系统中数据申报的关键操作说明
3.1基本信息维护操作说明
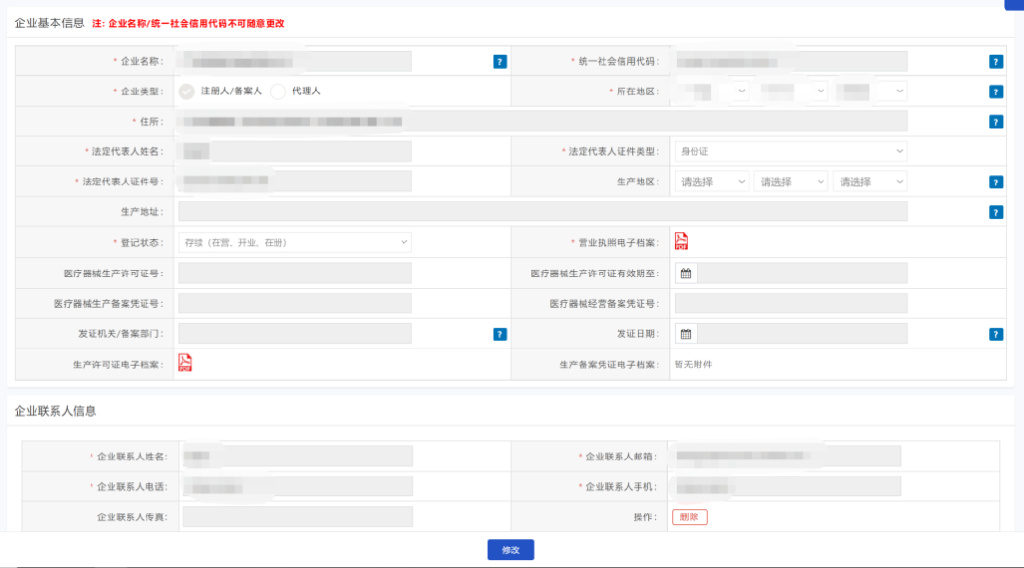
3.1.1企业基本信息维护操作说明
3.1.1.1点击“企业基本信息维护”菜单,跳转至企业信息表单页面,展示企业基本信息、企业联系人信息(负责医疗器械唯一标识数据库数据申报的人员)。
3.1.1.2如实填写企业基本信息
3.1.2注册/备案信息维护操作说明
3.1.2.1点击“新增”按钮,跳转至企业手动添加注册/备案信息页面;
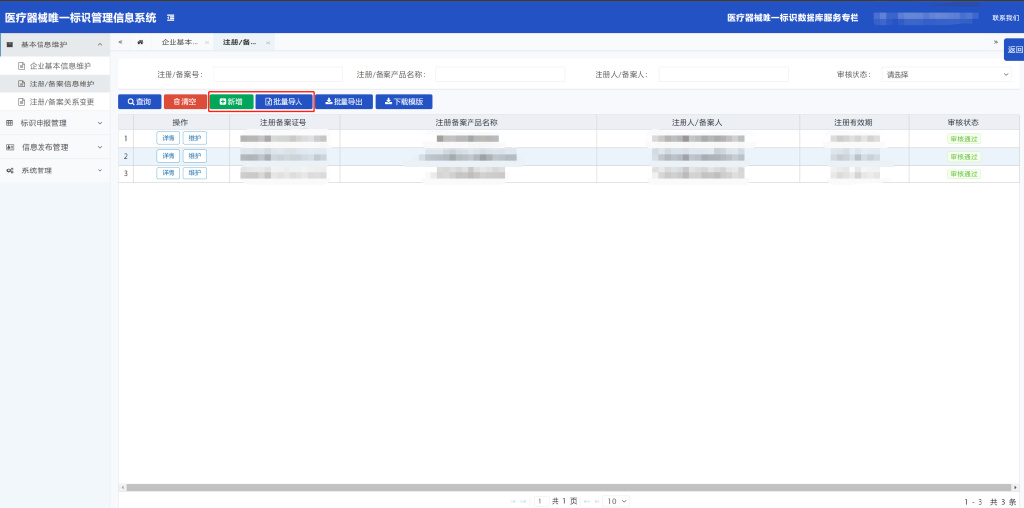
3.1.2.2如实填写注册/备案信息
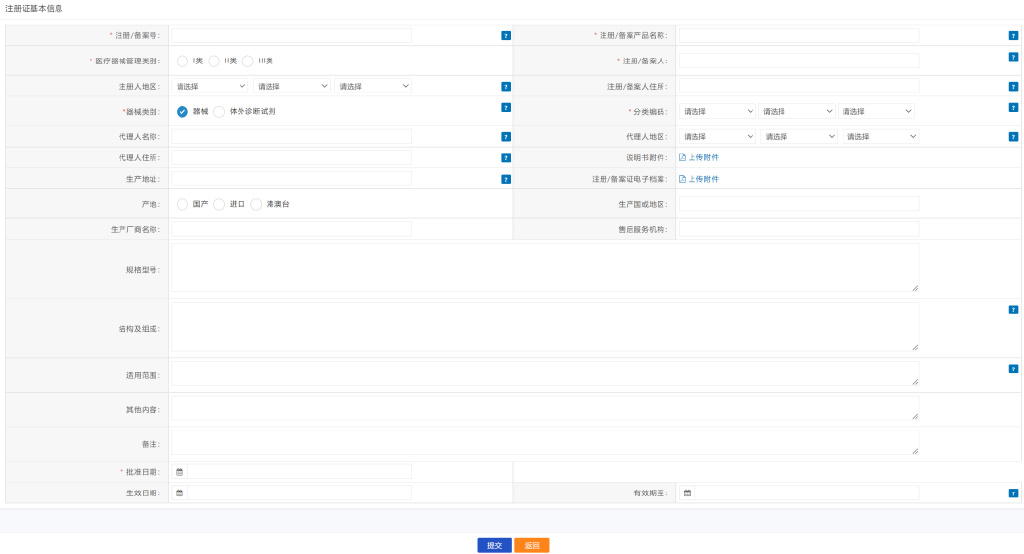
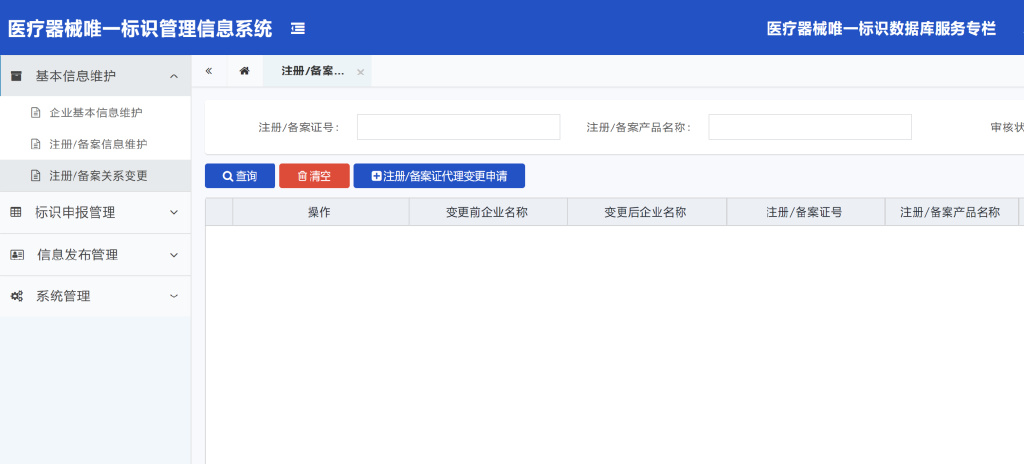
3.1.3注册/备案关系变更操作说明
3.1.3.1点击“注册/备案证代理变更申请”
3.1.3.2点击“选择注册证”,输入查询条件,点击“查询”按钮
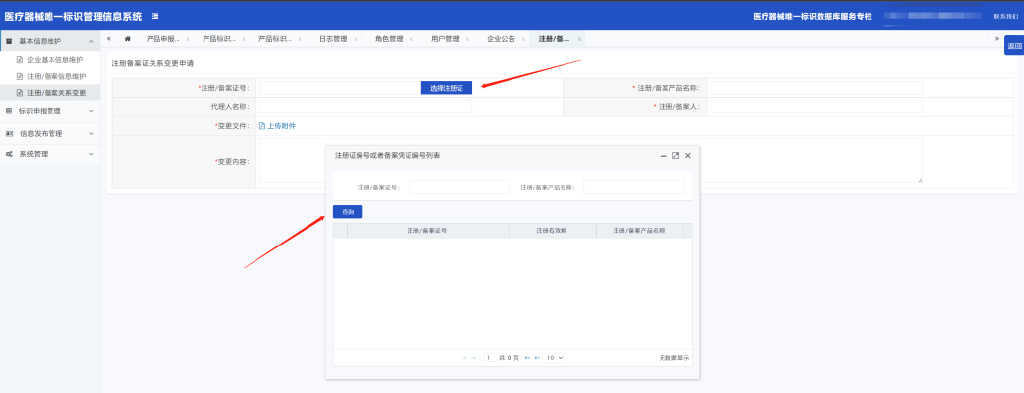
3.1.3.3如实填写变更内容,上传变更附件后,点击“保存”按钮。该变更记录则为“待提交”状态

3.1.3.4点击“提交”按钮并确定,该变更记录则提交至监管部门审核,同时状态更新为“待审核”;若监管机构审核未通过,则状态显示为“审核未通过”,可查看审核意见后重新申请;若监管机构审核通过,则状态更新为“审核通过”
3.2标识申报管理操作说明
3.2.1注册人/备案人可选择三种数据申报途径
网页填报
数据模板批量导入
数据接口自动上传
3.2.2注册人/备案人可选择三种数据申报途径
3.2.2.1点击“新增”按钮,跳转至企业手动添加注册/备案信息页面
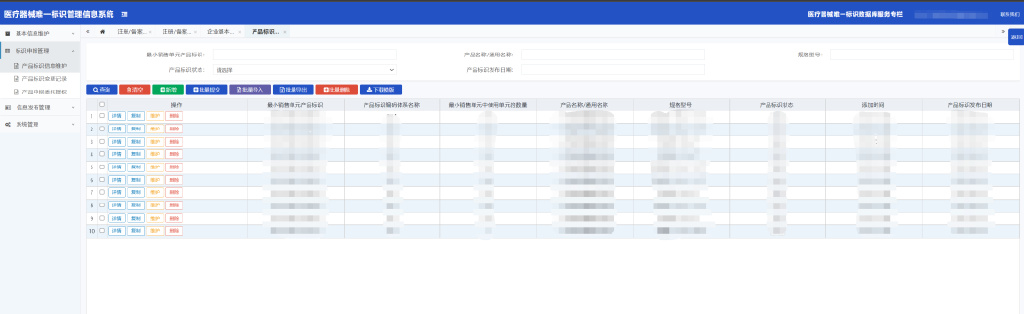
3.2.2.2填写产品标识基本信息及关键字段说明
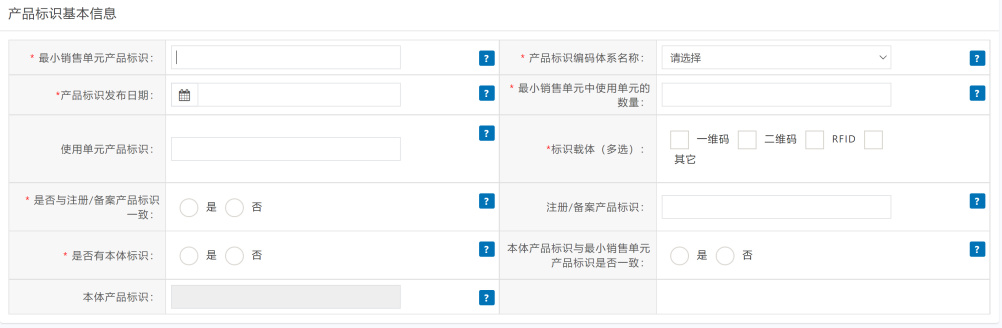
*最小销售单元产品标识:包含完整UDI的医疗器械的最低包装级别;
*产品标识发布日期:产品标识在医疗器械唯一标识数据库上对外发布的日期。建议根据产品销售上市的时间或者将来的某一个时间来综合考虑确定,留有足够充分的时间来保证产品标识记录数据的准确性以及完整性;
使用单元产品标识:当最小销售单元中使用单元的数量大于1时,该字段必须填写;
*产品标识载体:存储或者传输医疗器械唯一标识的数据媒介;
*是否与注册/备案产品标识一致:最小销售单元产品标识是否与产品注册/备案时所提交的产品标识相同;
*是否有本体标识:本体直接标识必须是完整的UDI,不是序列号。适用于可重复使用,两次使用之前需要再处理的产品;
3.2.2.3填写产品基本信息及关键字段说明
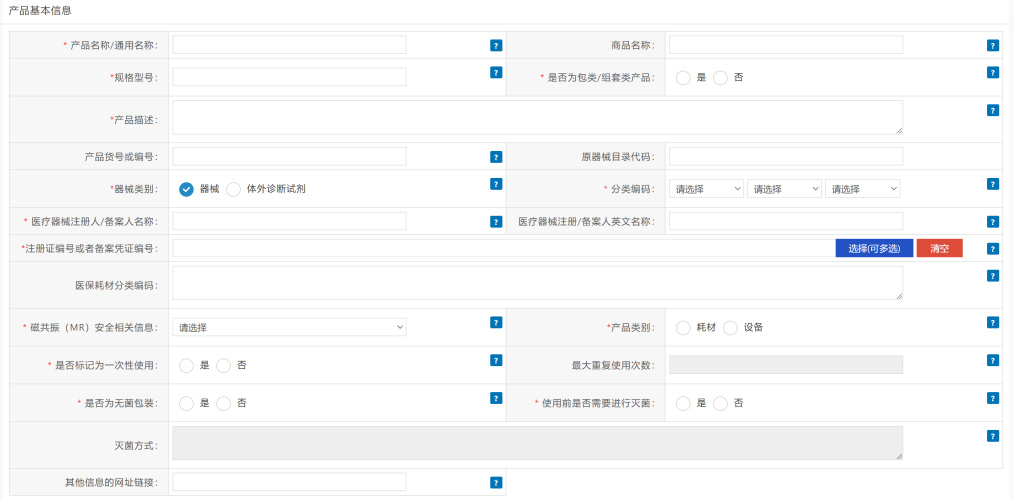
*是否为包类/组套类产品:包类/组套类产品包括手术包、体外诊断试剂套装、组套类等情况;
*产品描述:产品与最小销售单元产品标识一一对应必需的描述信息,包括产品注册证或备案凭证上附页相关描述以及其他必需的产品描述,应与最小销售单元产品标识一一对应;当医疗器械为包类/组套类产品(经批准的)时,还应列明所有组件的产品名称和数量;当医疗器械附带软件时,须列明软件版本号。
医保耗材分类编码:输入27位医保耗材分类编码。若存在多个医保耗材分类编码,可以英文“,”号分隔维护多个。此项如有,则需要填写;
* 分类编码:
a).当产品为医疗器械时,应选择现行有效的《医疗器械分类目录》(2017版);当产品按照新的器械目录分类编码无法进行明确归类时,选择“00:无”,代表无法纳入第一级或第二级;但22大类必须选择;目前仅公开大类;
b).当产品为体外诊断试剂时,应选择现行有效的《6840 体外诊断试剂分类子目录》(2013版)至二级;当出现二级需要选择多项,则选择主要的一项;当二级出现无法进行明确分类时,可选择一级大类中“23-其他(00:无)”;
*是否标记为一次性使用:一次性使用是指在医疗器械说明书或标签已注明“一次性使用”字样或者符号的情形;一次性使用包含使用一次即丢弃和同一患者在一次治疗过程中多次使用的情形;
最大重复使用次数:产品说明书或者标签上载明最大重复使用次数时,必须填写此项;
*是否为无菌包装:医疗器械是否为出厂前已灭菌的产品;
*使用前是否需要进行灭菌:医疗器械使用前是否需要进行灭菌
3.2.2.4填写生产标识信息、包装标识信息及关键字段说明

生产标识信息:如实填写
包装产品标识:
a).当医疗器械为多级包装时,必选;
b).当前级别医疗器械产品包装上的产品标识;
3.2.2.5填写储存或操作信息、临床使用尺寸信息及关键字段说明
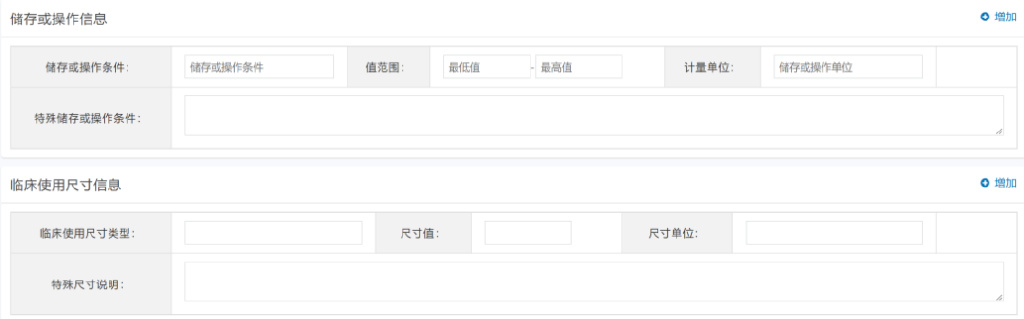
无必填项:企业可根据具体情况,酌情填写
3.2.2.6产品标识信息维护操作按钮说明

“详情”:点击后跳转至产品标识申报记录详情界面;
“复制”:点击后跳转至标识新增页面,并把选中产品的产品标识数据显示绑定到对应的输入项中,修改部分数据项即可(关键项,不做页面数据显示绑定);
“维护”:点击后跳转至产品标识的维护页面,更新编辑完成后,点击“提交”按钮系统规则校验通过后保存更改(对草稿状态的产品标识记录可编辑所有字段);
“删除”:针对草稿状态的产品标识数据,点击“删除”按钮后,对选中产品标识数据进行永久性删除,此操作不可恢复;
3.2.3产品标识变更记录
3.2.3.1产品标识记录对外发布后,产品标识记录数据不可编辑;当注册人/备案人发现已发布公示的数据存在错误或其他原因的产品标识相关数据的变更,可进行变更申请操作;
3.2.3.2注册人/备案人根据需要在产品标识信息管理页面列表中选择需要进行变更申请的产品标识记录,点击“变更”按钮,跳转该产品标识变更申请表单页面,对可编辑的字段进行编辑更新,并上传变更说明文件,编辑完成点击“提交”按钮并确定,通过系统规则校验通过,提交至相关监管部门审核。
二、其他相关说明
1.角色管理
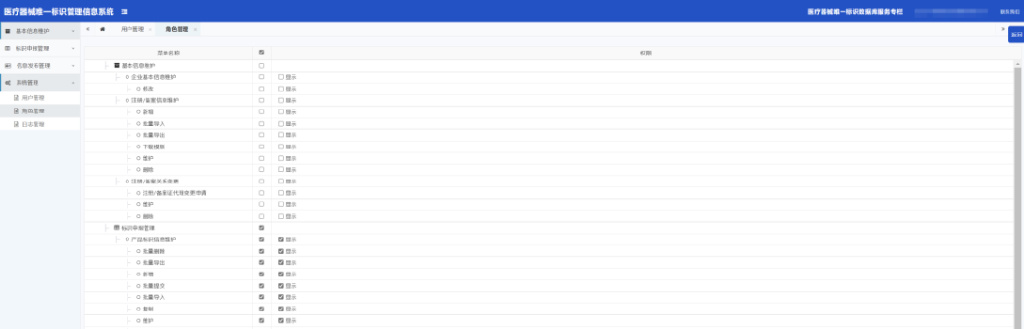
查询:输入查询条件,点击“查询”按钮,根据查询条件查询信息
新增:点击“新增”按钮,进入新增页面,填写表单中相关信息(*为必填项)后,点击“提交”按钮并确定,通过前台非空与格式校验后,则新增成功,若未通过校验则可根据提示信息修改相关项,完成后列表可查看;
启用:勾选状态为“禁用”的角色,点击“启用”,点击“确定”,启用成功;
禁用:勾选状态为“启用”的角色,点击“禁用”,点击“确定”,禁用成功,并将该角色下的子用户一并禁用;
权限设置:通过“操作”菜单栏中的“权限设置”按钮,进入选择权限页面,如图:勾选相关权限后,点击“保存”,弹出提示框,点击确定,权限更新成功;
2.用户管理
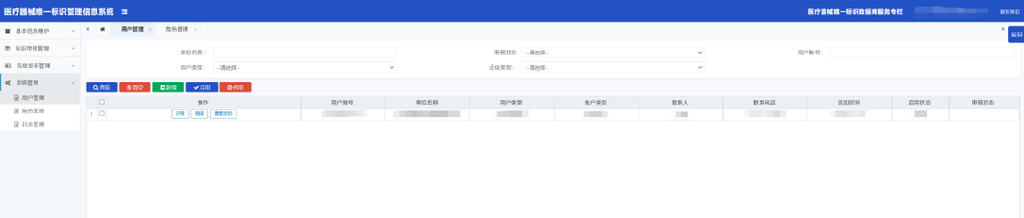

查询:输入查询条件,点击“查询”按钮,根据查询条件查询信息;
新增:点击“新增”按钮,跳转子页面,填写表单中相关信息(*为必填项)后,点击“提交”按钮并确定,通过前台非空与格式校验后,则新增成功,若未通过校验则可根据提示信息修改相关项;企业仅可创建业务账户,完成后列表可查看;
启用:勾选状态为“禁用”的用户,点击启用,弹出提示框,点击确定,启用成功;
禁用:勾选状态为“启用”的用户,点击禁用,弹出提示框,点击确定,禁用成功;
编辑:点击“操作”菜单栏中“编辑”按钮,弹出编辑子用户界面,在页面中正确输入子用户信息,点击“保存”,弹出提示框,点击确定,通过前台非空余格式校验后则修改用户信息成功。
作者:曹红洋

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享





 豫公网安备 41010202003160号
豫公网安备 41010202003160号